03.11(MON)2024
原著論文発表
【衛生化学研究室】 ヒトPPARα/δ/γサブタイプと8種PPARアゴニストの組合せによる差動的な4種Coactivatorリクルート能の発見(Biomedicines誌に掲載)
当研究室における研究「Different Coactivator Recruitment to Human PPARα/δ/γ Ligand-Binding Domains by Eight PPAR Agonists to Treat Nonalcoholic Fatty Liver Disease」が、MDPIの学術雑誌Biomedicinesにオンライン掲載されました(2024年3月11日)
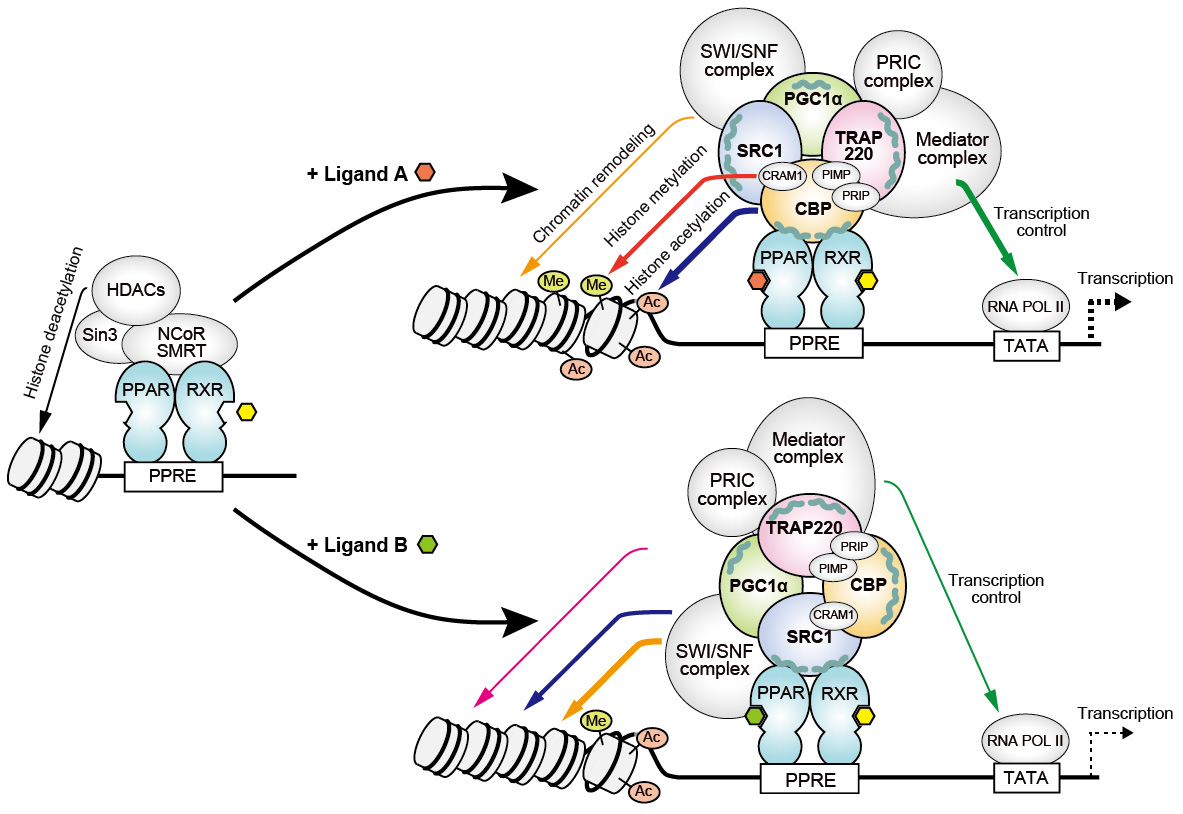
PPAR(peroxisome proliferator-activated receptor)は、脂質代謝?糖代謝など代謝全般を統括的に制御するリガンド活性化型?転写因子型核内受容体であり、一群の代謝関連遺伝子を駆動できることから、次世代のNASHなど代謝性疾患の創薬標的として期待されています。通常は、内在性脂肪酸などの活性の無いリガンドが結合することでCorepressorタンパク質複合体が結合して転写活性化を抑えていますが、PPARリガンドが結合すると活性化し、Corepressorタンパク質複合体を解離してCoactivatorタンパク質複合体を結合し、制御下の一群の遺伝子の転写活性化を誘導します。その際、リガンド結合により活性化したPPARα/δ/γはそれぞれRXRとヘテロダイマーを形成し、PPAR応答配列(PPRE)と呼ばれる共通のゲノムDNAコンセンサス配列を認識して結合することが知られていましたが、PPARα/δ/γサブタイプの1つ、2つ、あるいは3つに作用する各種PPARアゴニストによって異なる遺伝子発現が惹起される分子メカニズムは不明でした。
我々は、①どのPPARリガンドもPPARα/δ/γのいずれかに結合して、それぞれLXXLLモチーフを有するたった1つのCoactivator分子をリクルートする、②リクルートされるCoactivator分子はさらに多くの転写制御に関わるCoactivator分子種と巨大なタンパク質複合体を形成し、そのそれぞれが異なる酵素活性を有する、ことに着目し、異なるPPARα/δ/γサブタイプとPPARアゴニストの組合せがリクルートするCoactivator分子は異なる、あるいは少なくとも親和性が異なっていると考えました。そこで、100種以上のCoactivator分子種の中から、ほぼ全ての臓器組織に発現する代表的な4つのLXXLLモチーフを有する分子種(PGC-1α、CBP、SRC1、TRAP220)のペプチドを用いて、NASH治験薬候補であるFibrate系薬のBezafibrate、Fenofibric acid、Pemafibrate及びチアゾリジンジオン系のPioglitazone、また過去NASH治験薬であったか現在そうであるElafibranor、Lanifibranor、Saroglitazar、Seladelparの8種リガンドによるヒトPPARα/δ/γリガンド結合部位へのCoactivatorリクルート能を比較しました。その結果、それぞれが異なる親和性で4種Coactivator分子種をリクルートすることが判りました。この結果として異なる遺伝子転写活性化が起こりうることから、特定Coactivatorを選択的に動員できるリガンドを選択あるいは設計することで、目的とする治療効果が最大かつ副作用の少ない薬の開発に繋げられると考えています。